TUGAS FISIKA
INTI
SIFAT-SIFAT INTI
ATOM
Disusun oleh:
Nama :
Tiara Veronica
NPM :
A1E014013
Semester :
VI A
Dosen Pengampu :
Eko Risdianto,M.Cs
UNIVERSITAS BENGKULU
FAKULTAS KEGURUAN DAN ILMU
PENDIDIKAN
JURUSAN PENDIDIKAN
MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PROGRAM STUDI PENDIDIKAN FISIKA
2017
INTI ATOM
A.
Struktur Atom
Untuk
mengetahui distribusi muatan positif dan negatif dalam atom, maka Rutherford melakukan
eksperimen hamburan partikel alpha. Adapun eksperimen tersebut adalah sebagai
berikut, partikel alpha dilewatkan dan kolimator dan ditumbukkan pada suatu
lapisan logam tipis. Sebagian partikel diteruskan dan sebagian dihamburkan
(dibelokkan). Partikel alpha yang terhambur disebabkan oleh gaya elektrostatik
antara muatan positif dari partikel alpha dengan muatan positif dan negatif
dari atom penyusun lapisan logam tipis. Hamburan dengan sudut 900 disebabkan
oleh proses hamburan tunggal dengan medan listrik yang kuat. Dan hasil
eksperimen ini dapat disimpulkan bahwa muatan positif dan bagian terbesar dan
massa atom terkonsentrasi pada bagian yang sangat kecil, yang kemudian dikenal dengan
inti atom. Jumlah elektron yang mengimbangi muatan positif dan atom penyusun
lapisan logam tipis diperkirakan terdistribusi mengelilingi dimensi atom. Gaya
antara partikel alpha dengan muatan positif atom adalah
dimana
:
Z.e
: muatan pada pusat atom
Zα.e
: muatan partikel alpha
d
: jarak antar keduanya
Rutherford menjelaskan bahwa jejak partikel alpha
dalam medan inti adalah berbentuk hiperbola dengan inti sebagai fokus eksternalnya.
Persamaan hamburan untuk menentukan jumlah partikel alpha yang terhambur telah
diturunkan dan eksperimen tersebut.
Dimana :
n = jumlah partikel alpha yang bertumbukan
t = tebal lapisan logam
N =jumlah
inti tiap volume penghambur
Mα = massa partikel alpha
vα =
kecepatan awal partikel alpha
r =
jarak dan titik hambur
θ =
sudut hamburan
B.
Komposisi Inti Atom
Dan
eksperimen Rutherford dapat dijelaskan tentang model inti, penentuan muatan
inti dan ukuran inti atom. Karena muatan dalam inti merupakan kelipatan eksak
dan muatan proton dan massa inti merupakan kelipatan eksak dan massa proton,
maka dianggap bahwa semua inti tersusun dan proton. Jika ada inti bernomor
massa A dan nomor atom Z, maka inti tersebut mengandung A proton dan (A-Z)
elektron supaya muatan positifnya menjadi Z. Hipotesis proton-elektron ini
memiliki kelemahan, yaitu elektron yang terdapat di dalam inti harus memiliki
panjang gelombang de Brogue (λ= h/mv) yang tidak boleh lebih besar daripada
ukuran inti (10-12cm). Pada kenyataannya, elektron dengan panjang
gelombang de Broglie mi memiliki energi kinetik yang lebih besar daripada
partikel beta yang dipancarkan dan inti atom. Oleh karena itu hipotesis
proton-elektron menimbulkan keraguan bahwa elektron bebas merupakan partikel
penyusun inti atom.
Pada
tahun 1932, J. Chadwick menemukan neutron, yaitu partikel yang memiliki muatan
nol atau netral dan massanya mendekati massa proton. Karena hipotesis
elektronproton tidak dapat menjelaskan beberapa sifat inti, maka segera
ditinggalkan sesudah penemuan neutron ditinggalkan sesudah penemuan neutron.
Sejak saat itu mulai dipercaya bahwa inti terdiri dan neutron. Jumlah proton
dalam inti disebut sebagai nomor atom (Z). Jumlah neutron dalam inti disebut
sebagai jumlah neutron (N). Jumlah dan banyaknya proton dan neutron disebut
sebagai nomor massa (A). A=Z+N (1-3)
Simbol yang digunakan untuk menunjukkan jenis inti
adalah simbol kimia dan unsur tersebut dengan nomor atom di tulis sebagai
subscrip kiri dan nomor massa sebagai superscrip, misalnya memiliki nomor atom 2 dan nomor massa 4.
memiliki nomor atom 2 dan nomor massa 4.
C. Sifat-Sifat Inti Atom
 memiliki nomor atom 2 dan nomor massa 4.
memiliki nomor atom 2 dan nomor massa 4.C. Sifat-Sifat Inti Atom
a.
Sifat Inti Tak Bergantung Waktu
1.
Massa
Massa
inti atom sangat kecil jika dinyatakan dengan satuan massa biasa, yaitu kurang
dari 10.21 gram. Oleh karena itu harus dinyatakan dengan satuan yang berbeda.
Satuan yang diakui secara universal adalah didasarkan pada massa atom 12C
yang berada dalam keadaan netral dan tingkat energi dasar. Satuan yang dimaksud
adalah sma (satuan massa atom) atau amu (atomic mass unit).
Dari
kesetaraan massa dan energi (E = mc2), maka 1 sma setara dengan
energi sebesar 1,492232 x 10-10 joule. Dalam sistem atom, energi
pada umumnya dinyatakan dalam satuan elektron volt (eV). Satu elektron volt
didefinisikan sebagai energi yang diperoleh satu elektron yang bermuatan 1,6x10-19
coulomb setelah menempuh beda potensial sebesar 1 volt, atau
Massa
dari berbagai elemen atom diketahui lebih besar dan berat atom. Sebagai contoh
isotop oksigen 16O terdapat 8 proton, 8 neutron dan 8 elektron;
jumlah massanya sama dengan 16,132 amu, sedangkan berat atomnya sebesar
15,99491 amu. Isotop oksigen 16O lebih ringan 0,13709 amu dan elemen
penyusun. Perbedaan antara total massa proton, neutron dan elektron secara
individu dengan massa atom disebut mass defect. Persamaan untuk mass
defect adalah
dimana, Z : nomor atom MH : massa atom
hidrogen MN : massa neutron A-Z : nomor neutron M : berat atom.
Jika berat atom pada persamaan di atas diganti
dengan massa inti, maka massa atom hidrogen harus diganti massa proton.
1.
Jari-jari
Semua eksperimen yang dilakukan untuk menentukan
radius inti menunjukkan bahwa perkiraan secara kasar untuk radius inti adalah
dimana,
r0 : konstanta yang tidak tergantung pada A (sekitar 1, 1 sampai dengan
1,6 fm) dan A : nomor massa
Ø Ada
dua cara untuk menentukan r0:
a. Cara
nuklir
Dengan cara ini diukur
jari-jari gaya inti (nuclear force radius) yang didefinisikan
sebagai jarak dari pusat inti ke jarak jangkauan gaya inti. Jangkauan gaya inti
lebih panjang sedikit dari ukuran inti. Cara-cara yang masuk dalam kategori
ini:
·
Hamburan partikel alfa dengan hasil ro
= 1,414 F =1,414 x 10-13 cm
·
Peluruhan alfa dengan hasil ro
= 1,48 F = 1,48 x 10-13 cm
·
Hamburan neutron cepat dengan hasil ro
= 1,37 F = 1,37 x 10-13 cm
b. Cara
elektromagnetik
Jari-jari yang diukur
ialah jari-jari muatan inti. Percobaan yang termasuk kategori ini:
·
hamburan elektron dengan hasil 𝑟0=1,26
𝐹
·
Mesonik atom dengan hasil 𝑟0=1,2
𝐹
·
Inti cermin (1H3 3He3)
dengan hasil 𝑟0=(1,28
±0,05) 𝐹
·
Hamburan proton dengan hasil 𝑟0
= (1,25 ±0,05) 𝐹
·
Pergeseran isotropik dengan hasil 𝑟0=1,20
𝐹
r0=
1,37 x 10-13cm
Dengan
demikian volume inti sebanding dengan massa inti, sehingga semua inti memiliki
densitas yang hampir sama. Bentuk inti atom tidak selalu bulat (sferis) tetapi
dapat berbentuk oblate (IA=IB < IC) atau prolate (IA<IB =
IC) seperti bola rugby. Inti yang memiliki jumlah proton genap dan neutron juga
genap selalu berbentuk bulat (sferis). Inti dengan nomor massa (A) ganjil dapat
berbentuk oblate atau prolate.
2.
Muatan
Model atom Rutherford dapat menjelaskan spektra
sinar-X unsur-unsur yang diukur oleh Moseley(1913). Dari data Moseley diketahui
bahwa muatan inti adalah Z.e dengan Z adalah nomor atom dan e=+1,602 x 10-19
C.
3.
Momentum Sudut
Momentum sudut inti dapat diketahui dari hyperfine
structure atau
garis spektrum struktur atom, yang dapat diamati menggunakan
spektrometer dengan resolusi tinggi. Nukleon
dalam inti atom mempunyai spin ½. karena gerakannya di dalam inti atom maka proton dan neutron juga mempunyai momentum sudut
orbital.
Momentum
sudut total atau spin inti I merupakan jumlah vektor dari momentum sudut orbital L dan
momentum sudut spin S setiap nukleon.
4.
Momen Magnetik
Momen magnetik
adalah Medan magnet yang dihasilkan oleh suatu atom, ditentukan oleh kombinasi
berbagai macam momentum sudut. Di dalam inti atom nukleon-nukleon mengalami gerak
orbital. Proton maupun neutron mempunyai momen magnetik yaitu Mp
dan Mn.
Hubungan antara
momen magnetik proton Mp dengan momentum sudut orbital proton
LP memenuhi:
Komponen momen magnetik
proton dalam arah sumbu z memenuhi:
Dengan Lp = mlℏ.
Nilai momen magnetik sudut orbit proton dalam arah sumbu z
dapat dinyatakan:
Dengan µN
dikenal sebagai magneton nuklir.
Hubungan antara momen
magnetik
spin proton Msp dengan momentum sudut spin proton Sp memenuhi:
Nilai momen
magnetik sudut spin proton dalam arah sumbu z :
Dengan cara yang sama hubungan antara momen magnetik
sudut spin dan momen sudut spin untuk neutron memenuhi:
Selanjutnya
nilai momen magnetik sudut spin neutron dalam arah sumbu z:
5.
Momen Listrik
Momen kuadrupol
inti pertama kali dideteksi oleh Schuler dan Schmidt (1935) pada saat mereka menjelaskan hyperfine stuktur 151Eu
dan 153Eu. Adanya momen kuadrupol inti menunjukkan distribusi
muatan inti tidak simetris bola, melainkan sedikit berdeviasi. Konsep multipol
listrik dapat diterangkan dengan teori
potensial elektrostatis.
 |
| Gambar 1 Multipol Listrik |
Pada umumnya
multipol listrik dapat dinyatakan dengan 2. Berdasarkan angka 2 tersebut maka
untuk :
l = 0 ; 20 = 1 ; monopol
l = 1 ; 21 =
2 ;
dipol
l = 2 ; 22 = 4 ; kuadrupol
l = 3 ; 23 =
8 ;
oktupol
l = 4 ; 24
= 16 ;
hexadecapol
b.
Sifat Inti Bergantung Waktu
1.
Peluruhan Radioaktif
Peluruhan radiokatif adalah peristiwa hilangnya
energi dari inti atom yang tidak stabil dengan memancarkan radiasi dan partikel‐partikel pengion. Peluruhan, atau hilangnya energi,
ini akan menghasilkan jenis atom lain yang stabil. Atom baru yang dihasilkan
ini dinamakan inti anak (daughter nuclide), sedangkan atom yang meluruh
dinamakan inti ibu (parent nuclide). Sebagai contoh, atom karbon‐14 (ibu) akan memancarkan radiasi dan berubah
menjadi atom nitrogen‐14 (anak). Peristiwa
peluruhan merupakan peristiwa yang acak di tingkat atom, sehingga sangat sulit
untuk memrakirakan kapan suatu atom tertentu akan meluruh. Yang bias kita
lakukan adalah meperkirakan rerata peluruhan dari banyak atom yang sama.
Satuan SI untuk peluruhan radiokatif adalah
becquerel (Bq). Satu Bq didefinisikan sebagai satu perubahan (atau peluruhan)
per detik. Karena suatu sampel bahan radioaktif berisi banyak atom, satu Bq
adalah ukuran aktivitas yang sangat kecil; sehingga jumlah dalam orde TBq
(terabecquerel) atau GBq (gigabecquerel) banyak dipergunakan. Satuan
radioaktivitas yang lain adalah curie (Ci), yang pada awalnya didefinisikan
sebagai aktivitas satu gram radium murni, isotop Ra‐226. Sekarang ini satu Ci didefinisikan sebagai
aktivitas sebarang radionuklida yang meluruh dengan laju disintegrasi sebesar
3.7 × 1010 Bq. Ditinjau dari jenis dan besar energinya, radiasi radiokatif
dibedakan menjadi tiga macam (yang dinamakan sesuai dengan urutan alphabet
Yunani), yaitu radiasi alfa, beta, dan gamma. Peluruhan alfa hanya terjadi pada
unsur‐unsur berat saja (dengan nomor atom ≥ 52), sedangkan
dua jenis peluruhan yang lain bisa terjadi pada semua unsur.
 |
| Gambar 2. Peluruhan Radioaktif |
Ø Peluruhan alpha terjadi ketika suatu inti memancarkan partikel
alfa (inti helium yang terdiri dari dua proton dan dua neutron). Hasil
peluruhan ini adalah unsur baru dengan nomor atom yang lebih kecil.
Ø Peluruhan beta, diatur oleh gaya lemah, dan dihasilkan oleh transformasi neutron menjadi
proton, ataupun proton menjadi neutron. Transformasi neutron menjadi proton
akan diikuti oleh emisi satu elektron dan satu antineutrino, manakala transformasi proton menjadi neutron
diikuti oleh emisi satu positron dan satu neutrino. Emisi elektron ataupun emisi positron disebut
sebagai partikel beta. Peluruhan beta dapat meningkatkan maupun menurunkan
nomor atom inti sebesar satu.
Ø Peluruhan gama, dihasilkan oleh perubahan pada aras energi
inti ke keadaan yang lebih rendah, menyebabkan emisi radiasi elektromagnetik.
Hal ini dapat terjadi setelah emisi partikel alfa ataupun beta dari peluruhan
radioaktif.
Jenis-jenis peluruhan radioaktif lainnya
yang lebih jarang meliputi pelepasan neutron dan proton dari inti, emisi lebih
dari satu partikel beta, ataupun peluruhan yang
mengakibatkan produksi elektron berkecepatan tinggi yang bukan sinar beta, dan
produksi foton berenergi tinggi yang bukan sinar gama. Tiap-tiap isotop
radioaktif mempunyai karakteristik periode waktu peluruhan (waktu paruh) yang merupakan lamanya waktu yang diperlukan oleh
setengah jumlah sampel untuk meluruh habis. Proses peluruhan bersifat
eksponensial, sehingga setelah dua waktu paruh, hanya akan tersisa 25% isotop.
2.
Reaksi Inti
Reaksi inti sangat berbeda dengan reaksi kimia,
karena pada dasarnya reaksi inti ini terjadi karena tumbukan (penembakan) inti
sasaran (target) dengan suatu proyektil (peluru). Secara skematik reaksi inti
dapat digambarkan:
Pada
reaksi inti ini terjadi perubahan unsur karena ditumbuk zarah nuklir atau zarah
radioaktif yang dapat dinyatakan oleh persamaan reaksi:
Atau
A
(a, b)
B
dengan A adalah unsur semula, B adalah unsur yang terjadi, a dan
b adalah zarah yang ditumbukkan dan yang
terpental, dan Q adalah
energi panas yang mungkin timbul dalam reaksi inti tersebut. Apabila b =
a, dan B = A, maka pada reaksi tersebut adalah hamburan. Misalnya:
dengan p adalah proton. Dalam hal ini,
hamburannya tidak elastis dengan energi
kinetik proton yang terdisipasi
untuk mengeksitasi inti Mg yang pada deeksitasinya mengeluarkan sinar gamma. Pada reaksi inti
berlaku hukum: a. kekekalan momentum linier dan momentum sudut, b. kekekalan
energi, c. kekekalan jumlah muatan (nomor atom), d. kekekalan
jumlah nukleon (nomor massa). Dengan demikian, momentum, energi, nomor atom, dan nomor massa
inti-inti sebelum reaksi harus sama dengan
momentum, energi, nomor atom, dan
nomor massa inti setelah reaksi.
Suatu
reaksi inti bisa menghasilkan atau memerlukan
energi.
Besarnya energi Q bisa dihitung berdasarkan reaksi. Dalam
perhitungan energi reaksi inti,
semua massa inti dinyatakan dalam satuan sma
(satuan
massa atom). Menurut Einstein, energi total yang
dimiliki
suatu massa m adalah:
dengan
c adalah kelajuan cahaya (3 × 108 m/s). Dari persamaan tersebut untuk 1
sma, energi yang dimiliki adalah 931,5 MeV. Dengan demikian, persamaan energi (berdasarkan
hukum kekekalan energi) dapat dituliskan:
Atau
Dari persamaan (11.15), jika diperoleh nilai Q >
0, maka reaksinya disebut reaksi eksoterm, yaitu reaksi di
mana terjadi
pelepasan energi. Sebaliknya, jika Q < 0, maka reaksinya
disebut reaksi endoterm, yaitu reaksi yang
memerlukan energi. Persamaan
tersebut menunjukkan bahwa pada prinsipnya,
energi reaksi adalah sama dengan
perubahan massa inti sebelum reaksi dan sesudah reaksi. Hal inilah
yang dinyatakan Einstein sebagai kesetaraan massa-energi.
















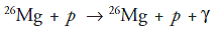


Tidak ada komentar:
Posting Komentar